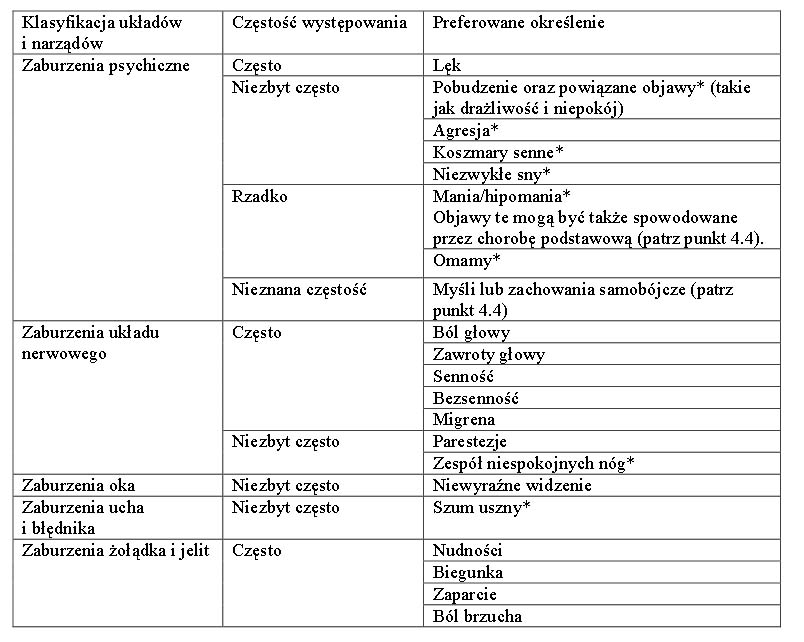
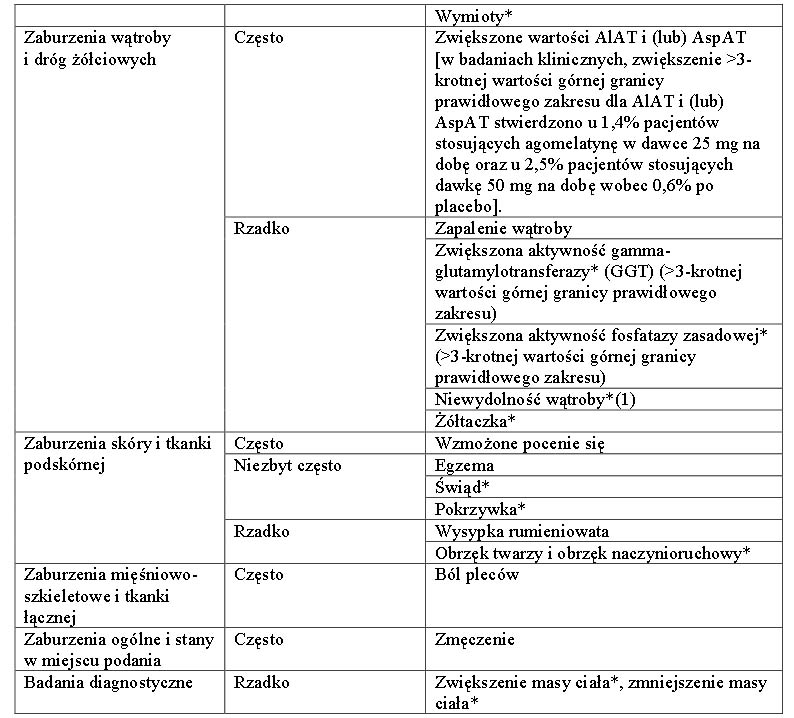
Większą skuteczność (2 badania) lub nie mniejszą skuteczność (4 badania) wykazano w sześciu z siedmiu badań w zróżnicowanych populacjach dorosłych pacjentów z depresją, w porównaniu z lekami z grup selektywnych inhibitorów wychwytu zwrotnego serotoniny (ang. SSRI) i inhibitorów wychwytu zwrotnego serotoniny i noradrenaliny (ang.SNRI) (sertralina, escytalopram, fluoksetyna, wenlafaksyna lub duloksetyna). Działanie przeciwdepresyjne oceniano za pomocą punktacji skali HAM-D-17 jako pierwszorzędowy lub drugorzędowy punkt końcowy. Utrzymywanie się skuteczności przeciwdepresyjnej wykazano w badaniu zapobiegania nawrotom. Pacjenci odpowiadający na leczenie przez 8/10 tygodni produktem Valdoxan w dawce 25-50 mg raz na dobę, podanym zgodnie z metodą otwartej próby, zostali przydzieleni losowo na dalsze 6 miesięcy do grupy otrzymującej Valdoxan w dawce 25-50 mg raz na dobę albo do grupy otrzymującej placebo.
Wykazano statystycznie istotną (p = 0,0001) przewagę produktu Valdoxan w dawce 25-50 mg raz na dobę nad placebo odnośnie pierwotnego punktu końcowego, zapobiegania nawrotom depresji,mierzonego jako czas do wystąpienia nawrotu. Częstość nawrotów podczas podwójnie zaślepionego 6-miesięcznego okresu obserwacji wynosiła 22% i 47%, odpowiednio dla produktu Valdoxan oraz placebo.
Produkt Valdoxan nie zmienia czuwania w ciągu dnia ani pamięci u zdrowych ochotników.
U pacjentów z depresją leczenie produktem Valdoxan w dawce 25 mg wydłużało sen wolnofalowy, nie modyfikując czasu trwania fazy REM (Rapid Eye Movement) ani nie opóźniając jej wystąpienia. Produkt Valdoxan w dawce 25 mg wywoływał także przyspieszenie czasu zapadania w sen oraz czasu do zmniejszenia częstości akcji serca. W ocenie pacjentów od pierwszego tygodnia leczenia znacznie poprawił się czas zasypiania i jakość snu, bez zaburzenia sprawności w ciągu dnia. W specyficznym badaniu porównawczym dotyczącym zaburzeń funkcji seksualnych u zdrowiejących pacjentów z depresją zauważono u stosujących Valdoxan liczbową tendencję (statystycznie nieistotną) do mniej licznych zaburzeń funkcji seksualnych niż u leczonych wenlafaksyną, w skali Sex Effects Scale (SEXFX), dotyczących osiągania podniecenia lub orgazmu. Zebrana analiza badańwykorzystująca Arizona Sexual Experience Scale (ASEX) wykazała, że stosowaniu produktu Valdoxan nie towarzyszyły zaburzenia funkcji seksualnych. U zdrowych ochotników produkt Valdoxan zachowywał funkcje seksualne w porównaniu z paroksetyną. W badaniach klinicznych produkt Valdoxan wykazywał neutralny wpływ na częstość akcji serca i ciśnienie krwi. W badaniu zaprojektowanym w celu oceny objawów odstawiennych za pomocą listy kontrolnej Discontinuation Emergent Signs and Symptoms (DESS) u zdrowiejących pacjentów z depresją, nagłe zaprzestanie leczenia produktem Valdoxan nie indukowało zespołu odstawiennego. Produkt Valdoxan nie ma potencjału uzależniającego, jak wykazano w badaniach u zdrowych ochotników za pomocą specyficznej wizualnej skali analogowej lub 49 punktowej listy kontrolnej Addiction Research Center Inventory (ARCI). W trwającym 8 tygodni badaniu kontrolowanym placebo, z zastosowaniem agomelatyny w dawce 25-50 mg/dobę u pacjentów w podeszłym wieku z depresją (≥65 lat, N=222, w tym 151 osób przyjmujących agomelatynę) wykazano statystycznie istotną różnicę 2,67 punktów w skali HAM-D, będącej pierwotnym punktem końcowym. Analiza odsetka osób reagujących na leczenie wykazała przewagę agomelatyny. U pacjentów w bardzo podeszłym wieku nie obserwowano poprawy (≥75 lat, N=69, w tym 48 osób przyjmujących agomelatynę). Tolerancja agomelatyny u pacjentów w podeszłym wieku była porównywalna do obserwowanej u młodszych osób dorosłych.
Przeprowadzono specyficznie kontrolowane, trwające 3 tygodnie badanie u pacjentów z ciężkimi epizodami depresyjnymi, których leczenie za pomocą paroksetyny (lek z grupy SSRI) lub wenlafaksyny (lek z grupy SNRI) było niewystarczające. Zmianie dotychczas stosowanego leku przeciwdepresyjnego na agomelatynę towarzyszyły objawy odstawienia, zarówno po nagłym przerwaniu terapii lekiem z grupy SSRI lub SNRI, jak i podczas stopniowego zmniejszania dawki. Te objawy odstawienia mogą być mylone z brakiem wczesnych korzyści ze stosowania agomelatyny.
Odsetek pacjentów, u których wystąpił przynajmniej jeden objaw odstawienia tydzień po zaprzestaniu leczenia lekiem z grupy SSRI/SNRI, był mniejszy w grupie o długim okresie zmniejszania dawkowania (stopniowe zaprzestawanie terapii lekiem z grupy SSRI/SNRI przez 2 tygodnie) niż w grupie o krótkim okresie zmniejszania dawkowania (stopniowe zaprzestawanie terapii lekiem
z grupy SSRI/SNRI przez 1 tydzień) oraz w grupie, u której dokonano nagłej substytucji (nagłe przerwanie stosowania leku) i wynosił, odpowiednio: 56,1%, 62,6% i 79,8%.
Dzieci i młodzież
Europejska Agencja Leków wstrzymała obowiązek dołączania wyników badań produktu leczniczego Valdoxan w jednej lub kilku podgrupach populacji dzieci i młodzieży w leczeniu dużych epizodów depresyjnych (patrz punkt 4.2 –informacja dotycząca stosowania u dzieci i młodzieży).
Właściwości farmakokinetyczne
Wchłanianie i dostępność biologiczna
Agomelatyna jest szybko i dobrze (≥80%) wchłaniana po podaniu doustnym. Całkowita dostępność biologiczna jest mała (<5% doustnej dawki terapeutycznej), a zmienność międzyosobnicza – znaczna. Dostępność biologiczna jest zwiększona u kobiet w porównaniu do mężczyzn. Dostępność biologiczną zwiększa przyjmowanie doustnych środków antykoncepcyjnych, a zmniejsza palenie tytoniu. Maksymalne stężenie w osoczu jest osiągane w ciągu 1 do 2 godzin. W zakresie dawek terapeutycznych ogólna ekspozycja na agomelatynę zwiększa się proporcjonalnie do dawki. Po większych dawkach występuje efekt nasycenia pierwszego przejścia. Spożycie pokarmu (posiłek standardowy lub bogatotłuszczowy) nie zmienia dostępności biologicznej ani szybkości wchłaniania. Zmienność jest zwiększona po posiłku bogatotłuszczowym.
Dystrybucja
Objętość dystrybucji w stanie stacjonarnym wynosi około 35 l, a stopień wiązania z białkami osocza 95% niezależnie od stężenia i nie ulega modyfikacji wraz z wiekiem oraz u pacjentów z zaburzeniem czynności nerek, ale wielkość wolnej frakcji jest podwojona u pacjentów z zaburzeniem czynności wątroby.
Metabolizm
Po podaniu doustnym agomelatyna jest szybko metabolizowana głównie przez wątrobowy izoenzym CYP1A2; izoenzymy CYP2C9 i CYP2C19 biorą także udział w metabolizmie, ale w mniejszym stopniu. Główne metabolity, hydroksylowane i demetylowe pochodne agomelatyny, są nieaktywne i zostają szybko sprzęgane oraz wydalane w moczu.
Eliminacja
Eliminacja jest szybka, średni okres półtrwania w osoczu wynosi od 1 do 2 godzin, klirens jest duży (około 1 100 ml/min) i głównie metaboliczny. Wydalanie zachodzi głównie z moczem (80%) i w postaci metabolitów, niezmieniony związek występuje w moczu w ilościach pomijalnych. Wielokrotne podanie nie zmienia kinetyki.
Zaburzenie czynności nerek
U pacjentów z ciężkim zaburzeniem czynności nerek (n= 8, pojedyncza dawka 25 mg) nie obserwowano istotnej zmiany parametrów farmakokinetycznych, ale należy zachować ostrożność u pacjentów z ciężkim lub umiarkowanym zaburzeniem czynności nerek, ponieważ dostępne są tylko ograniczone kliniczne dane ich dotyczące.
Zaburzenie czynności wątroby
W specyficznym badaniu ekspozycja na agomelatynę w dawce 25 mg u pacjentów z marskością wątroby, z przewlekłym łagodnym (typ A w klasyfikacji Child-Pugh) lub umiarkowanym (typ B w klasyfikacji Child – Pugh) zaburzeniem czynności wątroby, była znacznie zwiększona (odpowiednio 70 i 140 razy) w porównaniu do dobranych grup ochotników (wiek, masa ciała i nawyk palenia tytoniu) bez niewydolności wątroby.
Pacjenci w podeszłym wieku
W badaniu dotyczącym farmakokinetyki u pacjentów w podeszłym wieku (≥65 lat) wykazano, że po podaniu dawki 25 mg mediana wartości AUC i mediana wartości C max były około 4 razy i 13 razy większe u pacjentów ≥75 lat w porównaniu do pacjentów <75 lat. Całkowita liczba pacjentów otrzymujących dawkę 50 mg była za mała, aby móc wyciągnąć jakieś wnioski. Nie wymaga się dostosowania dawki u pacjentów w podeszłym wieku.
Grupy etniczne
Brak danych dotyczących wpływu rasy na farmakokinetykę agomelatyny.
Przedkliniczne dane o bezpieczeństwie
Działanie sedatywne obserwowano u myszy, szczurów i małp po pojedynczym i wielokrotnym podaniu dużych dawek. U gryzoni stwierdzono znaczną indukcję CYP2B i umiarkowaną indukcję CYP1A i CYP3A po dawkach powyżej 125 mg/kg mc./ dobę, podczas gdy u małp indukcja CYP2B i CYP3A po dawkach 375 mg/kg mc./dobę była niewielka. U gryzoni i małp nie obserwowano hepatotoksyczności w badaniach toksykologicznych z użyciem dawki wielokrotnej. Agomelatyna przenika przez łożysko i do płodu u ciężarnych szczurów. Badania rozrodczości u szczurów i królików wykazały brak wpływu agomelatyny na płodność, rozwój zarodkowo-płodowy, a także rozwój przed- i pourodzeniowy. Seria standardowych prób in vitro i in vivo dotyczących genotoksyczności wykazała brak potencjału mutagennego lub klastogennego agomelatyny. W badaniach dotyczących rakotwórczości agomelatyna wywoływała zwiększenie częstości występowania nowotworów wątroby u szczurów i myszy po dawce przynajmniej 110 razy większej od dawki terapeutycznej. Nowotwory wątroby są najprawdopodobniej związane z indukcją enzymów swoistą dla gryzoni. Częstość występowania łagodnych gruczolakowłókniaków gruczołu sutkowego u szczurów była zwiększona w przypadku dużej ekspozycji (ekspozycja 60 razy większa niż dawka terapeutyczna), ale pozostawała w zakresie takim, jak dla kontroli. Badania bezpieczeństwa farmakologicznego nie wykazały wpływu agomelatyny na prąd hERG (human Ether à-go-go Related Gene), ani na potencjał czynnościowy komórek Purkinjego u psów.
Agomelatyna nie wykazała właściwości prodrgawkowych po dawkach do 128 mg/kg mc. podanych dootrzewnowo u myszy i szczurów. Nie obserwowano wpływu agomelatyny na zachowanie młodych zwierząt, widzenie czy czynności rozrodcze. Obserwowano niewielkie, niezależne od dawki zmniejszenie masy ciała, związane z właściwościami farmakologicznymi oraz pewne mniejsze oddziaływania na układ rozrodczy u samców bez jakiegokolwiek zaburzenia czynności rozrodczych.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Rdzeń tabletki:
- Laktoza jednowodna
- Skrobia kukurydziana
- Powidon K 30
- Karboksymetyloskrobia sodowa typ A
- Kwas stearynowy
- Magnezu stearynian
- Krzemionka koloidalna bezwodna
Otoczka:
- Hypromeloza
- Żelaza tlenek żółty (E172)
- Glicerol
- Makrogol 6000
- Magnezu stearynianu
- Tytanu dwutlenek (E171)
Tusz zawierający szelak, glikol propylenowy i lak aluminiowy indygotyny (E132).
Niezgodności farmaceutyczne
Nie dotyczy.
Okres ważności
3 lata.
Specjalne środki ostrożności podczas przechowywania
Brak szczególnych środków ostrożności dotyczących przechowywania produktu leczniczego.
Rodzaj i zawartość opakowania
Blistry Aluminium/PVC pakowane w tekturowe pudełka (opakowanie kalendarzowe). Opakowania zawierające 7, 14, 28, 42, 56, 84 i 98 tabletek powlekanych. Opakowania zawierające po 100 tabletek powlekanych są przeznaczone do użytku szpitalnego. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Specjalne środki ostrożności dotyczące usuwania
Bez specjalnych wymagań dotyczących usuwania.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Francja
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
EU/1/08/499/001-008
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
19 lutego 2009 r